Das Entsalzen –
ein wichtiger Punkt beim Konservieren
Vom Entsalzen bzw. von der Entsalzung ist bei der Restaurierung von Bodenfunden immer wieder die Rede. Was genau hat es damit auf sich?
Der Boden enthält verschiedene Mengen an gelösten Salzen, das können Chloride, Sulfate, Nitrate und andere sein. Dabei ist es wichtig festzuhalten, dass der Anteil dieser Salze regional je nach
Bodenzusammensetzung sehr unterschiedlich sein kann. In Meeresnähe wird der Salzgehalt vermutlich höher sein, in der Nähe von viel befahrenen Straßen kommt die seit Jahrzehnten ausgeübte Praxis der
Salzung im Winter dazu. Nicht zu vergessen sind Salzlagerstätten, die durch die Erosion an der Erdoberfläche angelöst und frei gesetzt werden.
Die Salze im Boden entstehen durch Verwitterung des Gesteins, außerdem trägt die Düngung der Ackerflächen speziell mit chlorhaltigen Düngern ebenfalls zu teilweise starken Konzentrationen bei.
Dabei wirken die Chloride (NaCl, MgCl2, CaCl2, KCl u.a.) am stärksten korrosiv. Vor allem Eisen ist dem Zusammenhang ein permanentes Problem, da Eisen mit chlorhaltigen Verbindungen schwer bzw.
unlösliche Oxichloride bildet. Die genaue Zusammensetzung dieser chlorhaltigen Produkte ist nicht immer zu bestimmen, es ist aber davon auszugehen, dass sich bei länger im Boden befindlichen
Eisenfunden die Chloride als basische Oxichloride vorfinden. Wird das Fundstück dem Boden entnommen, können sich diese Verbindungen durch die Austrocknung und eventuelle Oxidation in noch schwerer
lösliche Komplexe verändern.
Daher ist es ratsam, die geborgenen Funde feucht zu halten und keinesfalls vollkommen auszutrocknen! Sollte es nicht möglich sein, eine entsprechende Lagerung zu gewährleisten, kommt die
Tiefkühlung in Frage. Bei Temperaturen von -20°C und darunter verlangsamen sich die Korrosionsprozesse stark.
Entfernung der Chloride
Seit über hundert Jahren ist die Ursache der Nachkorrosion bei metallischen Fundstücken, speziell Eisen und Bronze, bekannt. Und seit dieser Zeit wurden etliche verschiedene Methoden vorgeschlagen,
die geeignet erschienen, diese schädlichen Chloride aus dem Material zu entfernen.
Wie kann aber sich eigentlich noch Salz in einem Stück Eisen befinden, was völlig von seiner Korrosionsschicht befreit (komplett entrostet) wurde?
Zunächst ist es wichtig, festzuhalten, das metallische Fundstücke, auch wenn sie dem freien Auge kompakt und undurchlässig erscheinen, von sehr vielen, winzigen Rissen und Spalten durchsetzt sein
können. Diese Schäden können einerseits bereits bei der Herstellung (in früheren Zeiten waren die metallurgischen Fertigungsprozesse längst nicht so vollkommen wie heute und reine Handarbeit..),
andererseits durch die Korrosion entstanden sein. Daher haben die im Boden in gelöster Form (Grundwasser) vorliegenden Salze die Möglichkeit, auch in das kompakte Material einzudringen.
Das Problem der Entsalzung trifft also nicht nur auf die Rostkruste zu, sondern (zumindest teilweise) auch auf das kompakte Metall.
Nach (1) gibt es einen Grenz-Gehalt an Chlorid, unter dem keine Nachkorrosion bei Eisenobjekten mehr stattfindet. Dieser liegt um 0,02%. Ziel aller Entsalzungsmaßnahmen muss es also sein,
den Chlorid-Gehalt unter diese Marke zu reduzieren. Ob diese Größenordnung auch genügt, um die Korrosion bei Bronze aufzuhalten, ist nicht genau bekannt.
Es wurden nun zur Lösung dieses Problems zahlreiche mehr oder weniger aufwändige Verfahren entwickelt, die man in folgende Kategorien einteilen kann:
1. Waschverfahren (Auslaugung, Intensiv-Waschverfahren)
Zumeist wird bei den Auslaugungs-Verfahren destilliertes bzw. deionisiertes Wasser verwendet, das Lösungsvermögen ist gut und das Wasser ist preiswert.
Nachteil: Wasser fördert die Korrosion, auch sind die Behandlungszeiten sehr lang, mehrere Monate bis zu zwei Jahren. Das Wasser muss entsprechend häufig gewechselt werden.
Um die Korrosion beim Eisen zu bremsen bzw. zu stoppen, setzt man dem Auswasch-Wasser eine geringe Konzentration von NaOH (Natriumhydroxid, Ätznatron) zu. Normalerweise um die 1%, manche Angaben
sprechen auch von 0,1 – 3%. Weiterhin wird die Zugabe von Tensiden in ähnlichen Konzentrationen empfohlen, um die Oberflächenspannung des Wassers zu verringern.
Ein Nachteil der Verwendung von Zusätzen ist, man kann die Auswaschung der Salze aus dem Fundstück nicht mehr einfach mit einem Leitwert-Messgerät überprüfen. Dies gelingt nur, wenn ganz reines dest.
Wasser verwendet wird.
Eine Abwandlung des Waschverfahrens ist die Verwendung von organischen Lösungsmitteln. Deren Vorteil liegt in ihrer guten Benetzungsfähigkeit, außerdem sind sie korrosionsneutral.
Nachteil: Manche Lösungsmittel sind brennbar, teilweise giftig. Auch der Kostenfaktor spielt eine Rolle. Auch ist das Lösungsvermögen für anorganische Salze bei den Lösungsmitteln nur ungenügend
bekannt.
2. Waschverfahren mit chemischer Umwandlung der Salze
Die bekannteste dieser Methoden ist sicherlich das Auswaschen mit alkalischer Reduktions-Lösung. Diese besteht aus Natriumhydroxid (Ätznatron) und Natriumsulfit.
Nach (1) dringt diese Lösung besonders gut durch die Rostschichten und erreicht den Eisenkern. Auf dessen Oberfläche schaden die Salze am meisten.
Nachteil: Der Aufwand ist ziemlich hoch. Auch muss eine Temperatur von 50°C über einen langen Zeitraum gehalten werden, und das unter Luftabschluss. Sicherlich eines der aufwändigsten Verfahren.
Ein ähnliches Verfahren unter Anwendung von sog. Natriumsesquicarbonat wird zur Entsalzung von Kupferlegierungen empfohlen.
3. Elektrolytische Methoden
Bei diesen elektrochemischen Methoden werden zwei verschiedene Verfahren angewandt:
Entsalzung nach dem Mittelleiter-Verfahren und Entsalzung mit kathodischer Schaltung.
Nachteil: recht hoher Aufwand. Die Wirksamkeit dieses Verfahrens wird des öfteren angezweifelt.
4. Entsalzung durch Reduktion mit Wasserstoff
Bei diesen Verfahren gibt es einen Hochtemperatur–Methode bei 800°C und eine weitere, die bei 400°C arbeitet. Der hohe apparative Aufwand sowie die Sicherheitsmaßnahmen, die der Umgang mit Wasserstoff erfordert, machen diese Verfahren höchstens für gut ausgerüstete Laboratorien interessant.
5. Entsalzung mit gasförmigen Stoffen (Wasserdampf, Ammoniak)
Gasförmige Agenzien dringen wesentlich besser und tiefer in die Fundstücke ein als flüssige, aus diesem Grund sind die Entsalzungszeiten hier viel kürzer. Die Wirksamkeit wird als sehr gut
angesehen. Ammoniak wird hauptsächlich bei Bronze verwendet, könnte jedoch auch für die Entsalzung von Eisen interessant sein. Bei relativ kleinen Objekten einen gute Methode.
Nachteil: Bei größeren Fundstücken umständlich und relativ aufwändig. Der Umgang mit Ammoniak ist wegen der starken Reizwirkung schwierig.
6. Entsalzung durch Ausglühen bzw. reduktives Glühen
Verschiedene Glühverfahren sind früher häufig angewandt worden. Bei Temperaturen von ca. 400°C an verdampfen die unlöslichen Chloride und können aus dem Metall bei entsprechend langem Erwärmen
ausgetrieben werden, ist dazu noch eine reduktive Atmosphäre vorhanden, werden sie zersetzt. Das Erwärmen auf Temperaturen über 500°C verändert jedoch die Struktur des Metalls, was in manchen
Fällen unerwünscht ist.
Nachteil: Reduktives Glühen erfordert einen recht hohen Aufwand von der Technik her. Das Glühen in normaler Atmosphäre kann dagegen bereits in einem Muffelofen vorgenommen werden.
Durchführung der Verfahren
1. Waschverfahren mit dest. Wasser
Die größte Waschwirkung hat eine Waschflüssigkeit, die alle Risse und Kapillaren benetzen und so tief wie möglich in das Objekt eindringen kann. Am geeignetsten dazu ist Wasser-Dampf, gefolgt von heißem Wasser (80°C) und kaltem Wasser mit Zusatz an Netzmittel (Tensid, 0,5%). Die Waschflüssigkeit sollte einen pH-Wert von 12 - 13 haben um möglichst viel von den Chloriden aufzulösen. Zur Einstellung dieses pH-Wertes kann Natronlauge benutzt werden. Als Waschwasser wird grundsätzlich destilliertes Wasser verwendet. Ein häufiges Wechseln der Waschflüssigkeit bringt dabei keine Vorteile, weil die Diffusion des Chlorids nicht sehr schnell abläuft. Das Volumen der Waschflüssigkeit sollte mindestens 10-mal so groß wie das Volumen der Rostprodukte sein. Das ist natürlich ein grober Schätzwert, es ist sicher nicht möglich, ohne weiteres das genaue Volumen der Rostkruste zu ermitteln.
Man kann also sicherheitshalber immer von einem Mehrfachen an Volumen des zu reinigenden Objektes ausgehen, wenn das Eisenteil also z.B. eine Größe von etwa 10 mal 10x5 cm hat, stellt es ein Volumen von etwa 500 cm³ dar. Die Menge der Waschflüssigkeit sollte dann etwa 4-5 Liter betragen.
Es genügt in diesem Fall, das Waschwasser etwa einmal alle 10-15 Tage zu wechseln. Der Zusatz von Natronlauge und die damit einhergehende Erhöhung des pH-Wertes auf etwa 13 bringt die Korrosion während des Waschvorganges fast gänzlich zum Stillstand. Da die Dichte der Salzlösung etwas größer ist als die Dichte des sauberen Wassers, reichern sich die Chloride langsam am Boden des Waschgefäßes an. Deshalb wäre es ungünstig, das Eisenteil zu nahe am Boden anzuordnen. Ein größerer Auswasch- Effekt wird erreicht, wenn man das Waschobjekt an einer erhöhten Stelle im Bad anbringt.
Man kann die Entsalzung auch ohne einen Zusatz von Lauge zum Waschwasser vornehmen, die geringfügige Korrosion, die das Metall im Wasser erleidet, muss in Kauf genommen werden. Bei der Überlegung, ob mit oder ohne Zusatz von Natronlauge gearbeitet werden soll, kann die Art und Form des Fundstückes eine Rolle spielen. Bei kompakten, zusammen hängenden Metallteilen, wie z.B. einer Kanonenkugel, spielt die Nachkorrosion sicherlich nicht die gleiche Rolle wie bei einem filigranen Stück. Die Diffusionsfähigkeit reinen dest. Wassers ist sicherlich etwas größer als die einer (wenn auch stark verdünnten) Natronlauge. Beim Zusatz von NaOH (oder anderen Stoffen, wie Netzmitteln oder Komplexbildnern!) besteht der Nachteil, den Fortgang der Entsalzung nicht mehr mit einem einfachen Leitwert-Messgerät überprüfen zu können. Soll also mit einem Leitwert-Messgerät gearbeitet werden, dann nur reines, dest. Wasser verwenden.
Es wird ein ausreichend großes Gefäß aus Kunststoff oder Keramik benötigt. Das Gefäß muss groß genug sein, um das Eisenobjekt sowie eine Wassermenge aufnehmen zu können, die 4-5 mal größer ist als das Volumen des Eisenteils. Man bringt dann eine Unterlage in das Gefäß ein, so dass das Eisenteil nicht unmittelbar auf dem Boden liegt. Die Unterlage sollte aber nicht aus Metall bestehen. Den pH-Wert des Waschwassers stellt man ein, indem man pro Liter Waschwasser ein paar Stückchen festes Natriumhydroxid zugibt. Wenn das Eisenobjekt im Gefäß ist, wird es mit dem destillierten und alkalisch gemachten Wasser vollständig bedeckt. Die Entsalzung dauert auf diese Weise mind. 8 Wochen. Bei größeren Stücken kann das deutlich länger sein, bis zu einem Jahr. Ältere Fundstücke benötigen oft auch längere Zeit, da sie mehr Salze aus dem Boden aufnehmen konnten. Der Wascheffekt wird durch Zugabe von etwas Spülmittel (1-2 Tropfen auf den halben Liter) deutlich verbessert. Außerdem ist eine Behandlung mit heißem Wasser immer vorzuziehen, jedoch wird das nicht immer möglich sein.
Sehr wichtig ist es, das Eisenobjekt häufig umzuwenden, da der Auswascheffekt an der Unterseite am größten ist. Gelegentliches Umrühren verstärkt den Effekt. Alle 10-15 Tage die Waschflüssigkeit erneuern. Dem Waschwasser kann auch etwas EDTA zugesetzt werden, etwa 0,5 Gramm pro Liter.
Wenn möglich, erkannte Rostblasen, die Wasser enthalten können, anschleifen bzw. mit einem kleinen Bohrer öffnen, um den Zutritt der Waschflüssigkeit zu ermöglichen.
Anzumerken ist noch, dass beim Messen des Leitwertes alle Ionen im Wasser zusammen genommen einen Leitwert ergeben, also auch die im Laufe der Zeit langsam zunehmende Versauerung des Wassers durch Aufnahme von Kohlendioxid aus der Luft berücksichtig werden muss. Man wird also nie einen Leitwert erhalten, der bei Null liegt, für Wasser, welches lange Zeit der Luft ausgesetzt war.
Waschverfahren mit organischen Lösungsmitteln
Eine Abwandlung des Waschprozesses ist die Anwendung organischer Lösungsmittel an Stelle des destillierten Wassers. Diese Lösungsmittel haben gegenüber dem Wasser Vor-, aber auch Nachteile. Zu den
Vorteilen zählen geringe bzw. keine Verstärkung der Korrosion während der Entsalzung, gutes Eindringvermögen in das poröse Material sowie leichtere Verdunstbarkeit, welche die Trocknung unterstützt
und begünstigt. Die Entsalzung dauert mit diesem Verfahren scheinbar auch nicht so lange wie bei Verwendung von Wasser.
Zu den Nachteilen der Methode zählen der höhere Preis der Lösungsmittel sowie deren (teilweise) Brennbarkeit und ihre Giftigkeit. In dieser Hinsicht ist besonders das Methanol schwierig, obwohl
es in Bezug auf die Lösefähigkeit wiederum als günstig anzusehen ist. Die Löslichkeit der Eisenchloride in organischen Lösungsmitteln ist generell geringer als in dest. Wasser. Auch hier besteht
also ein gewisser Nachteil, der aber stark vom verwendeten LM abhängt.
Die ersten Versuche zu diesen Methoden gehen nach (10) auf die späten 60-er Jahre zurück, über Ergebnisse und Durchführung wurde in (11) berichtet.
Welche Lösungsmittel kommen in Frage?
Hauptsächlich polare LM wie Alkohole, spez. Methanol, Ethanol und die Propanole haben teilweise ein beträchtliches Lösungsvermögen für anorganische Salze. Auch in der Gruppe der Ketone finden sich
Lösungsmittel, welche geeignet scheinen. (Aceton, Methyl-Isobutylketon, MIBK)
Dimethylsulfoxid (DMSO) und Dimethylformamid (DMF) könnten ebenfalls in Frage kommen, jedoch ist beim DMF dessen Giftigkeit sehr hinderlich. Auch beim MIBK bestehen in dieser Hinsicht Bedenken,
dessen MAK beträgt 410 mg/m3 (10), ein unbedingt einzuhaltender Wert.
Auch das Pyridin weist entsprechende Eigenschaften auf, ist jedoch wegen der Geruchsbelästigung und einer gewissen Giftigkeit weniger geeignet.
Für die Verwendung kommen also hauptsächlich Methanol, Aceton und MIBK in Frage. Beim Aceton ist auf die besonders hohe Feuergefährlichkeit zu achten.
Da bei Verwendung eines org. LM die Möglichkeit der Leitfähigkeits-Messung entfällt, ist es prinzipiell schwieriger, den Verlauf der Entsalzung zu überwachen. Es ist möglich, bei den Alkoholen (Methanol und Ethanol) das in Lösung gegangene Chlorid direkt mit Silbernitrat-Lösung nachzuweisen. (Wie beim dest. Wasser!)
Ein Vorteil liegt beim Verwenden von MIBK darin, dass dieses nicht mit Wasser mischbar ist und durch Ausschütteln mit dest. Wasser in einem Scheidetrichter vom Chlorid befreit werden kann. Da MIBK eine geringere Dichte als Wasser aufweist, setzt es sich oberhalb des Wassers ab. Das Wasser lässt man dann ab. Das Ausschütteln wird wiederholt, bis sich im Wasser kein Chlorid mehr befindet (Silbernitrat-Probe!)
Durchführung der Entsalzung mit MIBK [nach (7)]
Die Entsalzung wird ähnlich wie mit Wasser durchgeführt. Die Dauer des Bades beträgt 3-4 Tage, das Lösungsmittel wird täglich gewechselt und aufgearbeitet. Bei dieser Bad-Dauer wird zur Verwendung
von Ultraschall als Beschleuniger geraten, ist das nicht möglich, verlängert sich die Entsalzungs-Dauer auf ca. einen Monat. Dabei sollte das Lösungsmittel so häufig wie möglich ausgetauscht werden,
was mit aufbereitetem MIBK (ausgeschüttelt) geschieht, erst für das letzte Bad wird frisches verwendet.
Die Aufbereitung erfolgt, wie erwähnt, durch Ausschütteln mit Wasser (Volumen-Verhältnis 1:1) nach drei–viermaligem Ausschütteln sollte kein Chlorid mehr im MIBK vorhanden sein.
2. Waschverfahren mit chemischer Umwandlung
Das bekannteste Verfahren hierzu ist sicherlich das alkalische Waschverfahren mit Sulfit-Lösung. Verwendet wird als Wasch- Agens die folgende Lösung:
| Bezeichnung | Menge / Anteil / Bedingung | Einheit |
| Natriumhydroxid (ätznatron) NaOH | 20 | g |
| Natriumsulfit Na2SO3 (wasserfrei) | 60 | g |
| Wasser, dest. | 1000 | ml |
Vorteil der Methode ist ihre hohe Wirksamkeit. Mit Hilfe des Verfahrens ist es möglich, auch den größten Teil der zunächst unlöslichen Eisenoxychloride aus den Korrosionsschichten zu entfernen.
Als Nachteile müssen der relativ hohe Aufwand und die lange Dauer angeführt werden.
Grundlage
Es wird davon ausgegangen, dass die reduzierend wirkende Waschlösung (unter Luftabschluss!) die Eisenchloride (und Eisenoxichlorid FeOCl) in stabiles Eisen-2,3-oxid Fe3O4 (Magnetit) umwandelt. Das resultierende Chlor würde Natriumchlorid bilden und in Lösung bleiben. Das Sulfit wird zum Sulfat oxidiert. Eine Veränderung der Korrosionsschicht selbst findet dabei nach (1) nicht oder nur in ganz geringem Ausmaß statt.
Durchführung
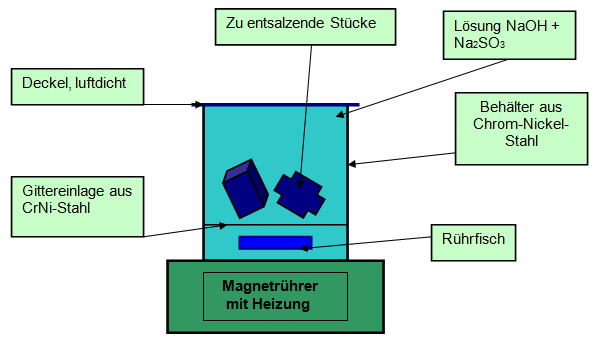
Benötigt wird ein dicht schließendes Gefäß aus Kunststoff, Glas oder Keramik, der Inhalt sollte etwas größer sein als die zu entsalzenden Gegenstände. Der Inhalt des Gefäßes muss bis unmittelbar
unter den abschließenden Deckel gefüllt sein, es darf sich keine Luft im Gefäß mehr befinden, da Natriumsulfit durch Sauerstoff oxidiert wird. Die Temperatur während der Entsalzung soll ca. 50°C
betragen, deshalb wird eine Heizschlange oder eine externe Heizplatte benötigt. Ein Magnetrührer ist sinnvoll, wenn die Installation möglich ist. Um den Boden des Gefäßes für den umlaufenden
Magnetrührer frei zu halten, die Eisenteile auf einem eingehängten Gitter aus Edelstahl anordnen. Das Rühren kann in Intervallen von einigen Tagen erfolgen. Die Dauer dieser Entsalzungsmethode ist
ziemlich lange, es werden etwa 4-5 Monate angegeben, was einen sehr hohen Aufwand, auch finanziell, darstellt. Die Ergebnisse scheinen jedoch sehr gut zu sein, vor allem, was die Entfernung der
unlöslichen Chloride angeht.
Nach (1) wird empfohlen, die Funde vor der Behandlung mit alkalischer Sulfitlösung einige Tage in 1%ige Ameisensäure einzulegen.
Ausführlich beschrieben wird das gesamte Verfahren in (4), auch die Bestimmung des Chloridgehaltes durch Titration mit Silbernitrat-Lösung wird geschildert.
Waschverfahren mit "Natriumsesquicarbonat" (Bronze)
Waschen mit einer Lösung aus Natriumcarbonat (Soda) und Natriumhydrogencarbonat (Natron) aus jeweils 50% Soda und Natron. (Also zum Beispiel als Lösung mit 25 g Natron und 25 g Soda auf 1000 ml dest. Wasser). Diese Mischung wurde früher auch Natriumsesquicarbonat genannt. Die Lösung soll mit einer Konz. von 5% eine Woche lang täglich gewechselt werden, dann einmal in der Woche, bis der durch Analyse bestimmte Chloridgehalt zurückgegangen ist. (Nach (12))
3. Elektrolytische Methoden
Grundlage des Verfahrens ist die folgende Überlegung: Im Wasser dissoziieren Salze in positiv geladene Metallionen, die sog. Kationen, und in negative Säurerest-Ionen, die Anionen. Legt man an diese Lösung jetzt eine Gleichspannung an, so bewegen sich die Ionen an den ihrer Ladung jeweils entgegen gesetzten Pol: die positiven Metallionen wandern zum negativen Pol, der Kathode. Und die negativen Säurerest-Ionen zum positiven Pol, der Anode. An der Anode erfolgt die Entladung der Anionen und die Bildung von Gas, im Falle von Chlorid im Wasser bildet sich dort Chlorgas.
Gebräuchlich sind zwei verschiedene Verfahren, zum einen das sog. Mittelleiter-Prinzip und zum anderen die kathodische Schaltung.
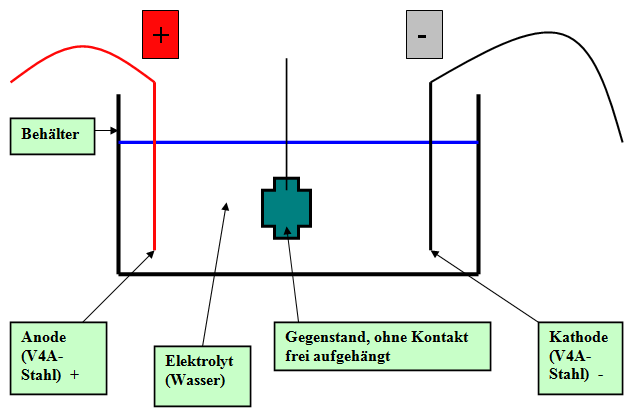
Schema: Prinzip des Mittelleiter-Verfahrens
In einem Behälter aus Glas oder Kunststoff werden die zu entsalzenden Teile zwischen zwei gegenüberliegenden Platten aus VA-Stahl (Nirosta) frei, d.h., ohne elektrischen Kontakt, eingebracht. Das kann bei einzelnen Stücken durch Aufhängung, bei mehreren durch Einbringen in Siebkörbe aus Kunststoff etc. geschehen. Die Platten dienen als Elektroden, Kathode und Anode. Als Elektrolyt dient deionisiertes bzw. dest. Wasser, die Spannung beträgt 8-10 V. Günstig wirkt eine Erhöhung der Temperatur auf 40–50°C, Wasserwechsel täglich. Dauer 5 Tage bis eine Woche.
Elektrolytische Entsalzung mit kathodischer Schaltung
Verwendet wird die selbe apparative Anordnung wie beim Mittelleiter-Verfahren, jedoch werden beide VA-Elektroden mit dem positiven Pol der Stromquelle verbunden. Zwischen die Elektroden kommt das
zu entsalzende Teil, welches negativ geschaltet wird. Bei zahlreichen kleineren Teilen ist das schwierig, man kann dazu Siebkörbe aus VA-Stahl oder Ähnliches verwenden.
Auch bei dieser Methode ist einen Erwärmung vorteilhaft, diese kann durch einen Tauchsieder oder einen ähnliche elektrische Heizvorrichtung realisiert werden. Generell ist es bei Verwendung erwärmter
Bäder sinnvoll, dieses mit einem Dämm-Material zu versehen, um das Auskühlen zu bremsen (Styropor).
Die Wirksamkeit der elektrolytischen Entsalzung mit kathodischer Schaltung ist nach (5) wirksamer als die nach der Mittelleiter-Methode, kann jedoch bei zu hohen Salzbelastungen zur Entrostung führen.
Der Elektrolyt (Wasser) wird dann durch die Salze so gut leitfähig, das die Absprengung und Reduktion der Rostkruste einsetzen kann. Es wird daher vorgeschlagen, zunächst nach dem
Mittelleiter-Verfahren und erst dann mit kathodischer Schaltung zu entsalzen (5).
Prinzip der Entsalzung mit kathodischer Schaltung
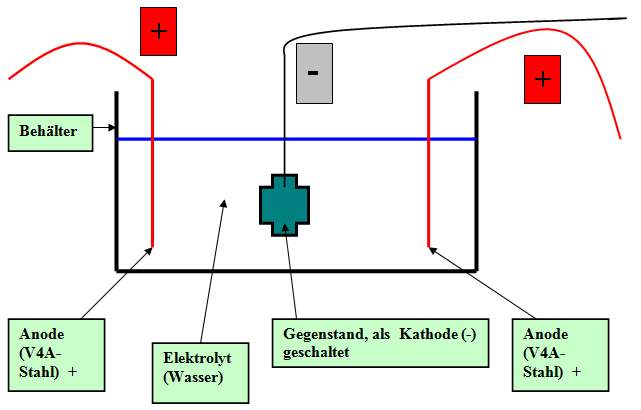
Schema: Entsalzung mit Fundstück als Kathode
Nach (5) wird als optimale Arbeitsweise vorgeschlagen:
Die Eisenteile werden zunächst 7 Tage nach dem Mittelleiter-Verfahren bei 40-50°C entsalzt, dazu wird Leitungswasser empfohlen. Der Wasserwechsel wird jeden Tag vorgenommen, es wird davon
ausgegangen, dass sich der größte Teil der Salze damit bereits gelöst hat. Anschließend wird dann noch einen Woche lang kathodisch entsalzt, jetzt mit destilliertem Wasser. Anschließend werden noch
je eine Badbehandlung (3 Tage) nach dem Mittelleiter-Verfahren und mit kathodischer Schaltung empfohlen, ist bei einer Titration mit Silbernitrat-Lösung dann kein Chlorid mehr nachweisbar, ist die
Entsalzung beendet.
Ein Nachteil des elektrolytischen Verfahrens ist die Bildung von Chlor und dessen relativ gute Löslichkeit in Wasser. Das führt zu Nebenreaktionen bei der Elektrolyse. Um diese gering zu halten, wird vorgeschlagen, Anionen-Austauscher zu verwenden, um das Chlor aus dem Elektrolyten zu entfernen. Dabei ist die Verwendung eines stark basischen Austauscher-Harzes sinnvoll, in (6) wird die Anordnung des Inonenaustauschers als Siebkorb vor der Anode beschrieben, so dass die Chlor-Ionen auf dem Weg zur Entladung an der Anode vom Austauscher absorbiert werden.
Ausführlich dargestellt und beschrieben werden die Vorgehensweisen zur elektrolytischen Entsalzung in (5) und (6).
Exkurs: Titration mit Silbernitrat-Lösung
Bestimmung von Chlorid mit Hilfe der Argentometrie (nach Mohr)
Die argentometrische Chlorid-Bestimmung nach Mohr arbeitet direkt mit Silbenitrat-Lösung.
Das Silbernitrat reagiert mit dem Chlorid auf folgende Weise:
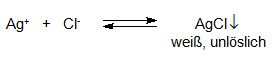
Es handelt sich bei der Methode um eine sog. Fällungs-Titration, um den Endpunkt erkennen zu können, benötigt man einen entsprechenden Indikator, in diesem Falle ist das Kaliumchromat, ein gelber
Feststoff, K2CrO4.
Man erkennt den End-Punkt der Titration an der beginnenden Ausfällung von rotbraunem Silberchromat. Der rotbraune Niederschlag entsteht erst, nachdem so gut wie alles Chlorid aus der Lösung
entfernt wurde.
Benötigte Geräte und Chemikalien
- Bürette
- Maßkolben 100 ml
- Becherglas
- Erlenmeyer-Kolben
- Trichter u. Filterpapier
- Messzylinder, Messpipette
- Stativ, Klemmen
- Kaliumchromat K2CrO4
- Silbernitrat AgNO3
Aus dem Kaliumchromat wird zunächst eine Lösung hergestellt:
| Bezeichnung | Menge / Anteil / Bedingung | Einheit |
| Kaliumchromat K2CrO4 | 5 | g |
| Wasser, destilliert | 100 | ml |
Von dieser Lösung werden als Indikator 2 ml der zu prüfenden Lösung zugegeben, und zwar je 100 ml der Lösung, die geprüft werden soll. Also bei 200 ml zu prüfender Lösung 4 ml Indikator-Lösung.
Die zur Titration verwendete Silbernitrat-Lösung. (0,1 m-Lösung)
| Bezeichnung | Menge / Anteil / Bedingung | Einheit |
| Silbernitrat AgNO3 | 17 | g |
| Wasser, destilliert | 1000 | ml |
Titration
Die zu analysierende Lösung muss neutral eingestellt sein.(pH 6,5–7,2; einstellen mit Natriumhydrogencarbonat oder Essigsäure!) Man lässt aus einer Bürette unter Rühren oder Umschütteln die Silbernitrat-Lösung zutropfen. Die zu analysierende Lösung trübt sich, Silberchlorid fällt aus. Der Umschlagpunkt ist an einer bleibenden (mind. 1 Minute!) Verfärbung ins Rotbraune zu erkennen, die Verfärbung tritt mitunter auch schon eher auf, verschwindet beim Schütteln aber wieder. Start und Endpunkte der Lösung auf der Bürette notieren (Verbrauch in ml). Diese Messung 3-mal durchführen.
Auswertung
Es werden so viele Ag+-Ionen verbraucht, wie Cl--Ionen in der Lösung vorhanden sind. Die molare Masse von Cl beträgt 35,45 g/Mol. Da mit einer 0,1 molaren Silbernitrat-Lösung gearbeitet wird, entspricht das 3,545 g/l. Je ml Silbernitrat-Lösung also 3,545 mg Cl- je ml der verbrauchten Lösung. Hat man also beispielsweise 14 ml Silbernitrat-Lösung bis zum erkannten Umschlagpunkt benötigt, dann entspricht das 14 x 3,545 = 49,63 mg Chlorid-Ionen in der zu prüfenden Lösung. Der Mittelwert aus drei Messungen wird gebildet.
Ergänzende bzw. empfehlenswerte Literatur:
Jander-Blasius: Einführung in das Anorganisch-Chemische Praktikum ; S. Hirzel Verlag Stuttgart – Leipzig 1995, S. 389-391
5. Entsalzung durch Anwendung gasförmiger Stoffe
Gasförmige Agenzien haben einen großen Vorteil: Sie dringen bedeutend tiefer und sehr viel schneller in das zu entsalzende Objekt ein als flüssige Mittel. Hauptsächlich angewandt werden zwei verschiedene Verfahren: die Entsalzung mit Wasserdampf beim Eisen und die Verwendung von Ammoniak bei Bronze.
Entsalzung mit Wasserdampf
Gerade bei kleineren Teilen (ideal bei Münzen!) kommt auch noch das Dampfentsalzen in Frage. Dazu wird ein üblicher Schnellkochtopf benötigt. Den Kochtopf füllt man zu einen Fünftel mit Wasser, das Stück kommt in den Einhängekorb, so dass es über die Wasseroberfläche hinausragt. Anschließend wird dann mind. 2 Stunden gekocht. Nach Ende der Kochbehandlung werden die Teile herausgenommen und in 80°C heißes Wasser eingelegt. Wenn das Stück die Temperatur des Wassers angenommen hat, herausnehmen und über dem Wasser hängend trocknen lassen.
Bei größeren Teilen ist diese Methode natürlich schwieriger anzuwenden. Was die Effektivität betrifft, ist es eine der besten und schonendsten Entsalzungs-Verfahren.
Entsalzung mit Ammoniak
Als Entsalzungs-Medium dient Ammoniak in Form einer 12,5 bis 15%igen Lösung (Salmiakgeist). Dazu wird ein dicht schließendes Gefäß aus Chromnickel-Stahl, Glas, Keramik oder beständigem Kunststoff (PE, PP, PVC) benötigt. Wegen der extrem reizenden Ammoniak-Dämpfe muss das Gefäß gut abdichten, auch ist es nötig, beim Öffnen für gute Luftzufuhr zu sorgen, Atemschutz verwenden! Bei kleinen Stücken wie Münzen ist diese Methode sehr einfach durchzuführen. Die Münzen kommen in das Gefäß, am besten auf einen Sieb-Boden, der sich einige cm über dem Salmiak-Geist befindet. Diese Ammoniak-Lösung wird vorher in das Gefäß gefüllt. Man verschließt jetzt und setzt die Gegenstände der Ammoniak-Wasserdampf-Atmosphäre aus. Nach (9) bilden sich bei hohem Gehalt an Chloriden auf der Oberfläche der Stücke blaue Tröpfchen, ist der vorhandene Chlorid-Gehalt eher gering, dann tritt nur Feuchtigkeit auf der Oberfläche auf. Ab und zu nimmt man jetzt das Stück aus dem Gefäß heraus, spült mit destilliertem Wasser ab und trocknet, günstigerweise unter einer Infrarot-Lampe. Man wiederholt dieses Verfahren (Bedampfen mit Ammoniak, Waschen, Trocknen) so lange, bis die zu entsalzenden Gegenstände während des Bedampfens vollkommen trocken bleiben. An Stelle des dest. Wassers kann zum Abspülen auch Aceton verwendet werden bzw. man bringt die Teile für eine Stunde in warmes (25°C) Aceton.
Dieses Verfahren ist, wie erwähnt, für Bronze-Teile entwickelt worden. Es ist jedoch anzunehmen, dass es auch beim Eisen anwendbar sein könnte.

Bild: Zum Entsalzen mit Ammoniak kann man Gefäße wie diese verwenden. Die Münzen werden in den Siebeinsatz aus Chrom-Nickel-Stahl eingelegt, dazu genügt ein einfaches Teesieb wie hier. Durch die
Gummi-Dichtung ist Gasdichtheit gewährleistet. Diese Anordnung lässt sich auch zum Patinieren verwenden, s. d.
Die Bedampfung mit Ammoniak wird in der Literatur als wirkungsvolle Methode behandelt, allerdings verändert sie etwas die Optik der Bronze.

Bild: Die Patina wird durch die Behandlung mit gasförmigem Ammoniak etwas dunkler. Oben vor, unten nach NH3-Begasung.
6. Entsalzung durch Wärme-Behandlungen (Glühen)
Da die schwerlöslichen Eisenoxychloride nicht temperaturbeständig sind und bei etwa 200°C beim Erhitzen an der Luft einer Umwandlung in Eisen-3-oxid und Eisen-3-chlorid unterliegen (7), bietet es
sich an, eine Erwärmung auf über 320°C vorzunehmen. Bei dieser Temperatur verdampft das Eisen-3-chlorid. Eine echte Glüh-Behandlung, wie sie mit Temperaturen von ca. 800°C früher oft vorgenommen
wurde, wäre also nicht unbedingt nötig. Gefüge-Umwandlungen beginnen beim Eisen (Stahl) erst bei längerem Erhitzen über 500°C, nach (8) kann man 10 Stunden bei 400°C und 1 Stunde bei 500°C
erwärmen, ohne dass sich nennenswerte Umwandlungen im Metallgefüge ergeben. Es sind also auch Gegenstände, die auf 400°C erhitzt wurden, noch immer für metallurgische Untersuchungen geeignet.
Es wird in der Literatur angegeben, dass die Glühmethoden bei reduzierender Atmosphäre durchgeführt werden sollen. Das ist jedoch mit erhöhtem Aufwand verbunden. Ein reines Austreiben des Chlorids
durch die Temperatur (Verdampfen) erscheint jedoch einfach und sollte funktionieren. Dabei ist eine Temperatur von 400°C noch nicht als Glühbehandlung anzusehen. Das Erwärmen sollte nicht zu schnell
erfolgen, um keine zu starken Spannungen im Metall auszulösen. Das Erhitzen auf 400°C hat natürlich auch einen sehr guten Trocken-Effekt zur Folge.
Sehr filigrane bzw. extrem korrodierte Stücke sollten keiner zu starken Erhitzung (Glühen!) unterzogen werden, hier besteht erhöhte Gefahr von Schäden durch die Wärmeausdehnung, es ist günstiger,
bei solchen Teilen eine Entsalzung mit anderen Methoden zu versuchen.
Entsalzungs-Problematik bei Fundmünzen
Durch die Suche mit Metall-Detektoren werden viele Münzfunde auf Ackerflächen gemacht. Nun sind aber gerade Felder einer sehr intensiven Düngung mit verschiedenen Salzen ausgesetzt, hinzu kommen noch Gülle-Einträge und andere korrosiv wirkende Stoffe. Es ist daher logisch, dass gerade bei Funden, die von Ackerflächen stammen, die Entsalzung ernst genommen werden sollte. Viele Düngemittel enthalten Chlorid in beträchtlichem Maße, sind also eine Quelle für Nachkorrosion. Gerade bei kleinen Fundstücken wie Münzen, Fibel, Schmuckstücken usw. ist die Entsalzung einfach, selbst wenn man Methoden wie die Dampf- oder Lösungsmittel-Entsalzung anwendet. Bedingt durch die Kleinheit der Objekte hält sich der apparative Aufwand in vertretbaren Grenzen.
Literatur
- A. Rinuy; F. Schweitzer; "Entsalzung von Eisenfunden mit alkalischer Sulfitlösung" Arbeitsblätter für Restauratoren, Heft 1/ 1982 S. 160-174. Mainz
- P. Eichhorn, Eisenkonservierung und Restaurierung am Württembergischen Landesmuseum, Arbeitsblätter f. Restauratoren 174-80(1975)
- Ersfeld, J.; Bleck, R.-D.: Zum Problem der Entsalzung metallener Fundobjekte. - Weimar, 1981. - S. 23-61. -(Restaurierung und Museumstechnik; 4)
- Rinuy, A.: Vergleichende Untersuchungen zur Entsalzung von Eisenfunden, -Arbeitsblätter f. Restauratoren (1979) l, Gr. l, S. 130-140. Mainz.
- R. Wihr "Elektrolytische Metallentsalzung", Arbeitsblätter für Restauratoren Heft 2, 1972 S. 31-48
- P. Stumpf "Elektrolytische Entsalzung – immer noch aktuell!" Arbeitsblätter für Restauratoren H 1, 1977
- K. Seidel "Entsalzen von Eisenfunden mit organischen Lösungsmitteln", Arbeitsblätter für Restauratoren H 2, 1985
- Diskussion über die Konservierung eiserner Bodenfunde – 11. At der ATM Münster 1976, Arbeitsblätter für Restauratoren H 1, 1977
- Stambolov, T.; Bleck, R.-D.; Eichelmann, N.: Korrosion und Konservierung von Kunst- und Kulturgut aus Metall I. - 2. erg. Auf. - Restaurierung und Museumstechnik 8 (1990), Weimar.
- Ankner, D.: Entsalzen von Eisenfunden mit organischen Lösungsmitteln. - Arbeitsblätter f. Restauratoren (1986) l, Gr. l, S. 212. Mainz.
- Bleck, R.-D. Ein neuer Vorschlag zur Entsalzung archäologischer Bodenfunde aus Eisen, Neue Museumskunde 19» Berlin 1976, Heft 3, S. 280 -284
- Oddy, W.A.; Hughes, M.J.: "The stabilization of active bronze and iron antiquities by the use of sodium sequicarbonate", in Studies in conservation 15 London (1970) 3, S. 183-189
- Thouvenin, A.: Eine neue Methode zur Entchlorung von Bronzealtertümem, die von Ausgrabungen stammen. -Revue Archeologique 2 (1958) S. 180-182. Paris.
- Fankhänel, D.: Zur Entsalzung von Bronzeobjekten. - Arbeitsblätter für Restauratoren 21 (1988) 2, Gr. 2, S. 200-203. Mainz. S. 4
